リチウムイオン電池(基礎編・電池材料学)
背景
近年、リチウムイオン電池は・・・・・・と、ここまで書いて思ったのだけど、「リチウムイオン電池が如何に社会にとってありがたいか」というお話については、解説が山のようにあるので思い切って割愛する。とにかく、リチウム電池を高性能化することは、いろいろと(たぶん)すばらしい。
科学者やエンジニアとしては「高性能化できればいかに素晴らしいか?」ということを論じるよりも、むしろ「問題はどうやって解決され、実現するか?」ということであって、そのためには、お金・・・じゃなくて・・・・脳漿を絞って知恵と知識を駆使ししなければならない。(*1)
このページでは、リチウムイオン電池にこれから関わろうという理工系の学生さん向けに、現在(2012年1月)使われているリチウムイオン電池(*2)がどのような仕組みで動いているかということを、なるべく平易に解説することを目指す。
特に、材料化学学的な視点から、電池電圧と電池容量を中心に取り扱う。測定法とかの実践的なお話は、また別の機会に。あと、この文章は材料系・化学系の中山が書いたので、機械や電気工学的なことは書いてない(書けない)。それから、主観も入っているし、勘違いもあるかもしれないことをご了承してください。
---
*1 しかし研究費もあればいいなと思うこのごろ。
*2 現在動いている電池は、インターカレーション系がほとんどという認識です。
電池の材料構成と反応のイメージ
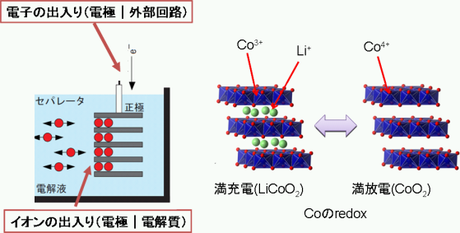
まず電池内部模式図を図1に示した。電池は、大雑把に言うと4つの材料(*1)で構成される。まず「正極」(一般的には+極でおなじみ)と「負極」(同様に-極)が電池の両端を構成しており、これらはまとめて「電極」という。どちらの電極にもリチウムを吸ったり(吸蔵)、吐き出したり(放出)する機能があり、充電時にはリチウムイオンは負極に、放電時には正極に移動している。そして、それぞれの電極は「電解質」に浸されており、電極間でのリチウムイオンのやり取りを担う。さらに、イオンだけが電極と電解質で勝手にやり取りすると、電極の電荷中性が保てなくなってしまうから、電荷中性を保存するように電子のやりとり(電流)も発生する。この役割を担うのが「外部回路」である。
ということで、電池を構成する材料について次のことが自明となる。
1) 電極: リチウムイオンと電子の吸蔵・放出が可能な材料である。(したがってイオンも電子も流せる)
2) 電解質: 電子は流さないが、リチウムイオンは流せる材料であること。
3) 外部回路: イオンは流さないが、電子は流せる材料であること。

もう少し詳細を述べる。リチウムイオン電池の模式図(図1)では、リチウムイオンは電解質の中を、電子は外部回路を伝って、常に等量(同じ数・等モル)動いていくことになる。(でないと、電気的な中性を保つことができない。)放電中は、負極から正極目指して電解質中をリチウムイオンが流れるので、同時に電子も正極から負極を目指して外部回路を流れる。そのとき、外部回路に適当な抵抗を設置してあげれば、流れる電子数を制御することになる。逆に充電時は外部回路に電源を設置することで電子の動きを制御することができ、同時にリチウムイオンの動きも制御することになる。このようにして、人間は外部回路を通して電池内部の反応を制御していることになる。
初学者に「なんで電解質中で電子が流れてはいけないのと?」と質問されることがあるのだが、それは常にショートした状態になってしまうからいけないのである。電解質の中で電子が勝手に流れてしまうと、外部回路で電子の動きを制御することで電池反応を制御することは不可能になってしまう。また、電池の中で電極同士を触れさせると電子が自由に正負両極を行きかうことができる(ショートしたことになる)ので、電池を組み立てる際には電極を触れさせないように万全の注意が必要である。実際の電池でも電極同士が触れないように、「セパレーター」と呼ばれる高分子膜を導入している(図1参照)。この材料は電解質は染み込む(イオンは流れる)けど電子的には絶縁材となる。
3)の電極についてもコメントをするならば、電極ではリチウムイオンと電子のやり取りをしているので、当然電極内部でイオンも電子も動かなくてはいけない。これについては、また別の機会でお話しする。
つぎに電解質だが、この材料の役割は正極と負極の間のリチウムイオンのやり取りを仲介することである。つまり正極と負極の間でリチウムイオンを輸送する役割を与えられている。イオンを十分流しさえすれば(現在使われている電解液は十分にリチウムイオンを流すと考えられている)、電池自体のエネルギーの貯蔵能には直接数字として影響しないので、少し前までは(個人的には)ちょっと日陰な感じもする材料であった。しかし、最近は安全性の面で新しい電電解質の開発が注目を浴びるようになってきている。これは、現在、エーテル系の有機溶媒にリチウム塩を溶かした材料を使っているためである。有機溶媒というのはガソリンのようなものだから、酸素と火花があれば激しく燃えてしまい危険なのだ。実際、エーテルというのは自身で酸素を持っているし、電極の酸化物もある意味で酸素の塊である。それから、電池というのは電極が電解液に突き刺さっているので、ショートしたらスパークして火花が出てしまうかもしれない。なので、リチウムイオン電池というのは、いくら頑丈な箱の中に入れていても内部で勝手に燃えてしまう危険性があるので、細心の技術によって安全性を確保しているのである。
---
*1 実際的にはセパレーターや缶体も必須材料なのだが化学反応には直接関与しないので、とりあえずこの話には登場しないことにする。
電池電圧のはなし1:電池反応によるエネルギーのやり取り
リチウムイオンを吸蔵・放出する材料によって電気エネルギーをためたりできるのは、リチウムイオンが負極に居るよりも正極に居たほうが化学的に安定であるためである。外部から電気エネルギーをもらう(充電)と化学的には不安定な状態(Liイオン@負極)になる。逆に負極から正極にリチウムイオンが移動して化学的に安定な状態(Liイオン@正極)になる過程では、外部に電気エネルギーを放出する(放電)。この放電反応を化学式風にあらわせば、
Vac@正極 + Li@負極 → Li@正極 + Vac@負極
となる。ここで、Vacはリチウムが抜けた状態を意味する。標準的な例として、正極にLiCoO2、負極にカーボン(C)を使った場合には、
CoO2 + LiC6 → LiCoO2 + C6
ということになる。化学反応で得られる最大の電気エネルギーは、ギブスエネルギー⊿Gを計算すればいいから(*1)、化学式を参照して、
⊿G={G(Li@正極)+G(Vac@負極)} - {G(Vac@正極) + G(Li@負極)}
を計算すればいいことがわかるであろう。これが放電時に電極間でリチウムが移動して外部に吐き出されるエネルギーになる。(充電はその逆で、外部から貯蔵するエネルギーとなる) ⊿Gは電圧Eと関連していて、
⊿G=-nFE
で表すことができる。なお、Fはファラデー定数(~96500 C/mol)、nは反応中に流れた電子量(モル)である。なお電圧Eはエネルギー(示量変数)ではなく、ポテンシャル(示強変数)なので単位も意味もちょっと違う。(*2)
一般に、熱力学関数であるギブス関数などを熱測定装置で精度よく決定することは非常に大変なのだが、電気化学反応系の場合は、安価な電圧計ひとつでかなりの精度の測定ができる(*3)
また普通の化学反応では、温度や圧力を変化させて反応を制御する。一方、電池反応の場合は単純で、外部回路を流れる電流を制御することで可能である。これは、電荷中性を保つために外部回路を流れる電子量と等モルのイオンが電極間で出入りするため、片方(電流)を制御するだけで反応を制御できるためである。
---
*1 ⊿G = ⊿H - T⊿S だから、ギブス関数とは系でやり取りされる総熱量(⊿H:エンタルピー@定圧)から、温度×エントロピー項(T⊿S)を引いたものである。これが、電力変換される分で、残り(エントロピー項)は熱として外部に出て行く、あるいは吸収される分になる。
*2 エネルギーからポテンシャルに変換させるため、n(mol)で割っている。詳しくは後述の予定。
*3 でも高い装置はたくさんある。電気化学反応系は電圧計にわずかなリーク電流でも流れると非平衡状態に陥ってしまうので、高内部インピーダンスの電圧計を使わなければならない。
電池反応のはなし:電極反応と材料(インターカレーション反応)
何回か述べたようにリチウムイオン電池の正極と負極は、リチウムイオンを出したり入れたりする能力がある材料である(あるいは、可逆的に挿入脱離することができる材料である)。具体的に、どうやってリチウムイオンを出し入れするのかというのは、材料の結晶構造を見てみると分かりやすい。図2は代表的な正極材料であるLiCoO2を示している。CoO6八面体の2次元層状シートが結晶構造の骨格を形成しており、その層の隙間にリチウムイオンが存在している。このような2次元構造のため、充電放電の際は、CoO2で作られる層状構造を維持したまま、リチウムイオンが出入りする。このような反応を特にインターカレーション反応と呼んでいる。
このとき、リチウムイオンが出たり入ったりしているだけでは電荷中性を保てなくなることを前述した。そのために、電子の授受も行われるのだが、リチウムイオンはずっとイオンであるため、電子の授受には関係しない(と思われる)。そのかわりにホスト格子を構成する遷移金属(Co, Ni,
Mnなど)が酸化還元する。図2の場合では、LiCoO2中でリチウムイオン(+)が出て行く(充電)場合には、電子(-)も抜けていってCo3+がCo4+になる。ということで、現在の電池では酸化還元ができる遷移金属は、材料の構成元素として必須となっている。
なお、正極だけではなく負極も似たような機構の逆反応が発生している。代表的な負極材料は層状グラファイトなどである。負極においても、リチウムはイオンとして層状構造の内部に吸蔵される。そのため、充放電を通して危険なリチウム金属相が出現しないため、安全な電池ということになっている(*1)。ずっとリチウムイオンとして存在しているため、リチウムイオン電池と呼ばれている。
---
*1 リチウム金属を負極に用いたリチウム金属電池は高性能が期待されるが、安全性の問題から2次電池次分野では使われていない(と思う)。)
容量密度の話2:理論容量と代表的な正極材料
エネルギー容量密度というのは、単位重量または単位体積あたり、どれだけ電気エネルギーを蓄えられるのか?ということを示す定量尺度である。当然、値が大きいほどいい。小さくて軽い電池の製造が可能となる。
電池の蓄えられるエネルギー(単位はW・hour)は、電圧(V)と電気量(A・hour)(*1)の積で表すことができるから、
体積エネルギー密度(W・hour/dm3) = 電圧(V)×電気量(A・hour)÷電極の体積(dm3)
重量エネルギー密度(W・hour/kg) = 電圧(V)×電気量(A・hour)÷電極の密度(kg)
となる。なので、電圧と電気量を増やすだけ増やして、電極の体積や重量を減らすことが「よい電池」を作るための条件となる。電圧については後述するとして、このセクションでは材料に蓄えられる電気量について議論したい。想定される電気化学反応において電極が蓄えることができる最大の電気量を理論容量と言う。(*2)
理論容量を決定するのは2つ要因がある。ひとつは、インターカレーション反応で電極が提供するリチウムイオンのサイト数(結晶中でリチウムイオンが滞在できる席の数)である。たとえば、LiCoO2では、CoO2に対して1つのリチウムイオンのサイトが提供される。あるいは、グラファイト(C)の場合では、C6に対してひとつのリチウムイオンのサイトが構成される。なので、LiCoO2の重量容量密度は、挿入脱離可能なリチウムイオン1molに対して、LiCoO2が1molである。LiCoO2の分子量は約98だから、98gあたり1モルのリチウムイオンが放出・吸蔵可能だということになる。
あとは、くだくだと単位変換が続く。1モルのイオンが動くときの電気量はファラデー定数から96500クーロン(C)の電気量に相当する。さらにクーロンを、通常使われる単位であるA・hourに変換すると、96500÷3600=26.8となる。さらに、98×10-3 kgあたりということなので、26.8(A・hour)÷98×10-3 (kg)=273
Ah/kg となり、これが理論密度になる。
ややこしいと思うので、重量理論容量について公式めいたものを書くと
貯蔵できるリチウムのモル数÷分子量×26.8×1000 = 重量理論容量 (Ah/kg または mAh/g)
になる。(上の説明中、有効数字はいい加減に取り扱ったので適当に補正のこと)。体積密度も上と同じ容量で考えれば算出できる。
しかし、これだけが理論容量を決定するわけではない。たとえば、電気化学的に不活性なAl3+でCo3+の半分を置換した系を考えてみる。つまり、LiAl0.5Co0.5O2のような系だ(このような相が安定かどうかは知らないけど)。この場合、系中にLiが1モルあっても、0.5モルのリチウムイオンを吐き出すと、酸化可能なCo3+がすべてCo4+になってしまい、これ以上反応を進めることはできなくなってしまう。なので、系中に含まれる遷移金属の数というのも理論容量を決める足かせになってしまうことに注意しなければならない。リチウムイオンの数あるいは遷移金属の数のどちらか小さいほうが容量を律することになる。
実は、遷移金属は電極材料中でかなりの重量を占める。そのため、多くの場合には酸化還元種となる遷移金属1モルに対してリチウム1モルになるように調整することで、理論容量を最適化することができる。以下に代表的な正極材料の理論容量と実際上の容量を示す。

1)層状岩塩型酸化物。 代表的なものとして、初めて商用化されたLiCoO2 (理論容量 273 Ah/kg)
がある。 この材料は系中のリチウムイオン1モルに対して、酸化還元種のコバルトイオン(Co3+/Co4+)が1モルとなっているので、上記の基準からすると理想的な材料である。しかし、リチウムイオンを半分抜くと(Li0.5CoO2)、相転移を起こしてしまい電池の寿命特性がかなり悪くなってしまう。そのため、理論容量の半分 135Ah/kgくらいしか実際上の充放電では使えない。そのため相転移を抑制することが必要であるといわれている。
LiNiO2も層状岩塩型であり、相転移がおきにくいためLiCoO2に比べて実容量は大きいと考えられている。しかし、Niの酸化数が変動しやすかったり、LiとNiの構造中での配置が一部でひっくり返ってしまうなど合成が難しいため実用にはいたらなかった。しかし、AlやCoをドープすることで層状岩塩構造が安定化する。たとえば、CoとNi、Mnを混ぜ合わせたLiCo1/3Ni1/3Mn1/3O2は、合成もしやすく実容量も200mAh/gを超えるので実用化されている(と思う)。
2)スピネル型酸化物。 実際に使われいるのはLiMn2O4 (理論容量 148 Ah/kg)
。組成から分かるように、マンガン2モルに対してリチウム1モルなので、遷移金属が多い分だけ、重量容量密度が低くなってしまう。しかしMnはCo、Niに比べて安いので、現在は広く使われているようである。
3)オリビン型酸化物。LiFePO4 (理論容量 170 Ah/kg) 遷移金属とリチウムイオンのモル比が1:1だが、直接酸化還元反応に寄与しないリン(原子量 ~31)と酸素が余分にあるので、LiCoO2の理論容量から比べると目減りする。
上述の例を考えていくと、たとえば、下記のような材料が作れて安定に動作すれば、かなり正極の容量を高めることができる。
4) Li2NiO2 (理論容量 510 Ah/kg)
系中にはリチウム2モルに対して遷移金属が1モルしかないので、結局リチウムは1モルしか反応できなさそうだが、NiがNi2+/Ni4+で酸化還元(2電子反応)してくれれば系中のすべてのリチウムイオンを吐き出すことができる。そのため、高い理論容量が得られる。
----------
*1 特に断りがない限り電気量=容量という扱いです。電気量というよりも電子量といったほうがいいかもしれないのですが。
*2 理論容量というだけあって、これ以上容量を増やすことは無理。根性とかでどうにかなる問題ではない。もし理論容量を超えるような容量を観測したら、想定している化学反応とは違う反応が起きていることになる。
電池電圧のはなし2: 化学ポテンシャルとフェルミ準位と電圧と電位
電池電圧は、エネルギー密度に直結する重要なパラメーターである。もちろん、高ければ高いほどエネルギー密度は高くなる。また、大型用途(自動車など)では電池を直列つなぎして高電圧化するが、ひとつひとつのセルの電圧が高ければ、直列に必要な電池の数が減ることも魅力である。そんなわけで、電池の電圧を高くすることは、一般的にいいことだといえる。(*1) ちょっと前に、電池電圧と熱力学関数(ギブス関数)との関係を述べたが、その知識だけでは結局のところ行き当たりばったりに高い電池の電圧を探さなければならない。そこで、もう少し原子・電子レベルの話(材料の組成や電子構造)と電池電圧の関係について述べていきたい。しかし、話はそんなに直接的ではなくて、「化学ポテンシャル」、「電圧」、「電位」「フェルミ準位」の話を経てて、ようやく次のセクションで材料の組成や電子構造の話をするつもりである。(*2)
まず、材料には固有のリチウムイオンの化学ポテンシャルが定義される。平たく言えば、ある材料におけるリチウムイオン(1個あたり)の居やすさ(安定性)である。図3の左側の模式図に書いてあるように、正極と負極に描かれた青と赤の実線で示しているのが、リチウムイオンの化学ポテンシャルのイメージである。青または赤線が高ければ高いほどリチウムイオンは居にくくて、化学ポテンシャルが低いところに移りたがることになる。高い化学ポテンシャルを持っているという。図からわかるように、正極は負極に比べて化学ポテンシャルは低く、そのため放電時は負極からリチウムイオンが正極に向かって移動するのである。この化学ポテンシャル差が電池電圧と対応する。

ところで、「電池電圧のはなし1」では材料固有の熱力学関数としてギブスエネルギーの話をしていたのに、突然化学ポテンシャルの話に切り替えたことについて説明したい。化学ポテンシャルとギブスエネルギーの違いというのは、ポテンシャル(示強変数)かエネルギー(示量変数)かということである。ポテンシャルというのは、「1粒子あたりの」という接頭語を入れるとわかりやすい。まさに「高さ」や「低さ」の概念に直結している。一方、エネルギーというのは、n個の粒子が持っているポテンシャルの総和であり、「多い」や「少ない」という量の考えである。結局のところ、「リチウムイオンの化学ポテンシャルμLi」とは、「リチウムイオン一個あたりのギブスエネルギーG」という言葉で説明される。(*3,
*4)
μLi = G / n
前に⊿G=-nFEという式を紹介したが、式変形をすれば E = -⊿G/(nF) =
μLi/Fとなり、化学ポテンシャルと電圧Eと一対一対応の関係にあることがわかる。以上のように電圧や化学ポテンシャルは粒子1個あたりの示強変数だということで、重要な結論である電圧に「加算性がない」ことがわかる。1molのLiCoO2に対して2molのLiCoO2が充電で蓄えるエネルギー量(示量変数)は2倍になるのだが、化学ポテンシャルは1molでも2molでも、物質量で割ってしまうので値は一緒。(1molあたりのエネルギー量なので、量を議論しても仕方ない。) それと同時に電圧Eも示教変数なので、1molのLiCoO2を使っても2molのLiCoO2を使っても電圧は同じになる。
以上のように電池電圧(voltage)は正極と負極におけるリチウムイオンの化学ポテンシャル差であることがわかった。ここで、もうひとつ「電位」(electric
potential)という用語についても説明したい。電圧と電位は時々混用されることがあるが、電圧は負極と正極の化学ポテンシャル差であるのに対して、電位はある基準電極の化学ポテンシャルを0としたとき、注目する電極材料の化学ポテンシャルを絶対値的に決定したものである。水溶液系での基準電極は、H+/H2の反応だが、リチウムイオン電池では非水溶液なので、リチウム金属電極のLi+/Li平衡電位を0と慣習的に定義している。単位に
V vs. Li+/Liとついていたら、Li+/Liを0V基準にして、そこから±~Vであるということを示していることに注意しなければならない。*6
最後に、フェルミ準位の話。電池電位はリチウムイオンの化学ポテンシャルと一対一対応があることを述べたが、材料のフェルミ準位EFとも対応している。これは図3の右側を見てもらえばわかると思う。ちなみに、フェルミ準位の熱力学的別名は、電子の化学ポテンシャルであり、電子(1個あたり)の電極での居やすさと理解することができる。また、フェルミ準位は示強変数である。
正極と負極材料のフェルミ準位をEF(正極)とEF(負極)であらわせば、電圧Eは、
E=EF(負極) - EF(正極)
になる。フェルミ準位の観点でみれば、負極のほうが正極より上になる。これは、電子の符号を+としないで、-にしてしまったことに由来する。
これで、電池電圧に関連する、電位、化学ポテンシャル、フェルミ準位のアイデアが出揃ったことになる。
---
*1 電池電圧が高すぎて電解質が分解してしまうと意味がなくなってしまうが。
*2 回りくどいのは中山の性格のためである。
*3 この式を議論するためにはエネルギーの絶対値を決めるという作業をしないといけないけれど。
*4 あまり上手い例ではないが、「低い化学ポテンシャルにあるリチウムイオンでも、たくさんイオンがあれば多量のエネルギーGになる」という文章の意味を考えてみると、「高さ・低さ」と「多い・少ない」の違いがわかるのかもしれない。
*5 ・・・こんなこと「当たり前やんけ」と罵声が飛びそうだが、電気化学の先生が期末試験の設問で言葉巧み誘導すると、勘違いして電圧を加算してしまう学生が多いのも現実。エネルギーとポテンシャルという用語の区別には注意を払ったほうがいいだろう。
*6 電池実験の多くの場合はリチウム金属を負極に採用しているので、電圧も電位もごっちゃになってしまうのだが。
電池電圧のはなし3: どうやったら電池電圧を高くできるのか?
前のセクションで触れたように、材料屋としては、「どんな組成・構造にすれば電池の電圧を高くしたり低くしたりすることができるのか?」(ほとんどの場合は電圧を高くしたいと思うのだが・・・)というある程度筋道だった法則を知りたいところである。上の図3に示したように、電圧は正極と負極のフェルミ準位差であるから、電圧を高くしたかったら正極のフェルミ準位を下げて負極のフェルミ準位をあげればよい。ただし、電池反応でリチウムイオンを使うからには、負極のフェルミ準位の上限は決まっていて、リチウム金属の溶出/析出電位である0
V vs. Li+/Liになる。これより高いフェルミ準位をもつ材料はもちろんあるが、電池として動作させると電極表面にリチウム金属が析出してしまう(そのほうが、系としては安定だから・・・)。ということで、高電圧の材料を探そうと思うと必然的に正極材料をいじるしかない。ここでは、主に正極である遷移金属酸化物を例に取り、固体のバンド構造の観点から説明を試みたい。
遷移金属酸化物のバンド構造の簡略図を図4に示した。大まかに言えば、価電子帯(電子占有軌道)は遷移金属Mのd軌道と酸素の2p軌道で構成されている。この二つの軌道は、共有結合である程度結ばれているので、かなり近い軌道レベルに現れる。この直上に電子が占有していないMのd軌道があるという状況である。

で、話を元に戻すと、Mの電子が占有している方のdバンドのレベルを下げることが、電池電圧を上げることになる。Mのdバンドの電子準位は、原子核(+のチャージ)から受ける静電引力の影響が大きい。単純には原子核の電荷が大きくなればなるほど、dバンド上に浮かんでいる電子が受ける引力は大きくなっていくから、周期表左側(前周期側)よりも右側(後周期側)のほうがdバンドは深く沈みこむ(エネルギー的に安定化する)と思われる。
実際にその考え方はある程度正しくて、前周期のTi3+/4+は1.5V、後周期のCo3+/4+,
Ni3+/4+は4V近辺で充放電する。ただし、d電子は原子核の核電荷全部から静電引力を受けているわけではなく、内側の軌道をめぐる電子によって電荷が中和されてしまっている(遮蔽効果)。遮蔽効果を考えたある実質的な原子核の電荷を有効核電荷という(*1)。したがって、正確には有効核電荷が大きくなればなるほど、dバンドが深く沈みこむと考えればよい。なお遮蔽効果や有効核電荷の定量的評価はスレーターの規則やクレメンティーの論文を参照すると良い。参考までにスレーターの規則から算出した遷移金属の有効電荷をリストアップした。見てわかるように、族の番号が増えると3d電子の感じる有効核電荷がどんどん大きくなっていくので、d軌道が沈み込んで電圧が上がっていくことがイメージできるだろう。ちなみに、周期表の縦方向、つまり4d,や5d遷移金属系はクレメンティーの論文を参照する(*2)と、3d金属に比べて有効核電荷が小さくなるので電圧はむしろ下がってしまう。
次に考えるべき効果は(陽)イオンの価数である。遷移金属の価数が上がれば静電相互作用の結果、電子を剥ぎ取りにくくなる(酸化しにくくなる)ことは直感的に理解できるであろう。(第一、第二、第三・・・イオン化エネルギーを比較すれば一目瞭然である。)なので、Co2+/3+の酸化還元系よりも、Co3+/4+の酸化還元系のほうが電圧は大きくなることになる。

ここまで話をすると大体お分かりのとおり、電位を制御する最大の要素は「遷移金属の元素/イオン種の選択」ということになる。結論から言えば、高電圧の材料を探すためには、周期表の上かつ後周期系で酸化数が比較的大きいイオンから選べばいいのでNi3+/4+とかCo3+/4+あたりが理屈上は最適材料ということになる。そして、それはとっくの昔から研究対象になっているので調べつくされている感もあり、新たな高電圧の酸化物を見つけるのは難しいだろうということになってしまう。
もうひとつ、重要な点について述べておきたい。先に述べたように遷移金属Mのdバンドを深く沈み込ませれば電圧が上がることを述べたが、酸化物の場合、d電子の軌道レベルは酸素の2pレベルにかなり近い。そのため、後周期遷移金属のCo3+/4+,
Ni3+/4+のようにd電子が深く沈みこんでいる酸化還元系では、d電子だけではなく酸素の2p軌道の電子も酸化還元に寄与することが知られている。逆に言い換えれば、仮にd電子のレベルをかなり深くする方法を発見しても酸化物である以上は酸素の2p軌道よりもフェルミ準位を下げることができないので、電圧は~5Vくらいが限界ということになってしまう。
-------------
*1 有効核電荷 = 原子番号 - 遮蔽定数
*2 スレーターの規則では3d金属も4d金属も5d金属も、族が同じだったら有効電荷は同じになってしまうが・・・。
電解質のはなし: 電池電圧を決定するもうひとつの要素(電位窓)
電解質というのは、正極と負極の間でリチウムイオンを伝達させる機能がある。しかし、裏を返すとリチウムイオンさえ流れれば、電池の電圧にも容量にも直接関与しない材料なのでデバイスのなかでは脇役になりがちである。実際に、現在使われているリチウム塩を溶かした有機溶媒系の電解質では、十分なスピードでリチウムイオンが流れてくれるので(正極や負極の活物質(固体)の中でノタノタ動いているリチウムイオンに比べれば圧倒的に速い!)、あんまり開発の対象には{無機屋の人間から見れば)思えないわけだが、それは大きな間違いである。電池の副反応の制御や、細孔内でのリチウムイオン拡散、電位窓などの観点で電池性能を大きく向上(あるいは低下)させる要因になる。最近では、有機電解液(環状エーテル)が自己燃焼性であることから安全性にたいするリスクが高く、電気自動車電源や定置電池実用化に必要な電池大型化を妨げる大きな要因となっている。とまぁ、電解質は将来の電池開発の脇役どころか主役になりえる材料なので、つらつらと電解質と電池の関係を述べようかと思ったのだが、中山は世俗的な話にはあんまり興味がないことに気付いたので、材料学的な観点から電位窓と電解質の話だけしようと思う。

電解質の電位窓というのは、正極と負極との組み合わせで電解質が安定に存在できる電位領域を指す。熱力学的な観点では、電解質のHOMOが正極のフェルミ準位より低く、電解質のLUMOが負極のフェルミ準位より高ければよい(*1)。例えば、LUMO準位が負極のフェルミ準位よりも低い水の場合は、Fig.5に示したように負極の電子が水のLUMOに自発的に流れてきてしまう。LUMOに取りついた電子は水分子を活性化してしまい、最終的にH2を生成するような還元分解反応を起こしてしまう。そのため、水は一般的にLUMOが負極に比べて低いためリチウムイオン電池に使うことができない。以上からわかるように、正極や負極をいくらデザインして高い電池電圧を得ようと思っても、電解質のLUMOとHOMOが上記の条件を満足しなければいけない。また、注意点として、電解質の耐電圧(*2)が~~Vという表現がときどき見られるがこれは間違いである。例えば耐電圧が4Vだから、電位5V(vs.
Li+/Li)の正極と、電位2V(vs. Li+/Li)の負極を組み合わせて、3Vの電池を構成したら、その電解質は使えるのではないかと夢想することもあるが、誤り。上で述べたように、電気分解は「正極と負極の電圧(電位差)が何Vなのか?」で決まるのではなく、電位(フェルミ準位 V vs.
Li+/Li)で決定する。だから、ある電解質の電位窓上限が 4V vs. Li+/Liであれば、、5V vs. Li+/Liの正極を使うことは、負極の選択いかんにかかわらずできない。
話を材料にもどす。現在使われている有機電解液系の場合はリチウム金属に対しては安定だが、正極に対しては4~5V vs.
Li+/Liくらいで分解してしまうことが経験的に知られている。ということで、LUMOは金属リチウムのフェルミ準位よりも上で、HOMOはLi金属基準で4~5V位にあるのかというと、それはちょっと何とも言えない。おそらくはHOMOもLUMOも正極・負極のフェルミ準位間の間に存在しているものと思われる。「それでは反応してしまうではないか?」ということになるのだが、おそらくその通りであり、あまりにも十分ゆっくり反応しているので我々が気が付かない(過電圧)か、反応してできてしまったもの(副反応生成物)が電極と電解質の界面に薄く堆積してしまい、しかもその堆積物が不活性(電位窓が広い)ため反応が停止することが起きているために、現在の電池は動いているのである。
---------------
*1 HOMOとLUMOは、一言でいえば電子が詰まっている最大軌道準位と詰まっていない最低軌道準位をそれぞれあらわす。よくわからない人は、一般的な化学の教科書に必ず掲載されているはず(そしておそらく大学の講義で先生が必死に教えているはず・・・)なので、それを参照してください。
*2 耐電圧というのは絶縁体に高電場をかけて絶縁破壊するような現象に対して使う用語だと思う。
まとめ
ヒコーキの中で推敲なし・つれづれなるまま的文章を書いているだけで息切れしました。ヒコーキというより、出張計画が無理すぎ(?)。ということで話はおしまい。気が向いたときに、今度は速度論的観点からリチウムイオン電池の反応を書こうと思います。まぁ読む人もいないでしょうが。
 Masanobu NAKAYAMA
Masanobu NAKAYAMA